Pendant des décennies, nous pensions connaître le rôle des mitochondries : ces minuscules organites étaient simplement les « centrales électriques » de nos cellules, produisant l’énergie nécessaire à notre survie. Mais une découverte scientifique bouleversante vient de révéler leur face cachée : elles sont en réalité des espions ultra-sophistiqués, capables de détecter la présence de bactéries dangereuses et de déclencher une contre-attaque immunitaire d’une précision chirurgicale. Cette révélation pourrait transformer notre approche du traitement des infections et expliquer enfin pourquoi certaines maladies auto-immunes affaiblissent paradoxalement nos défenses.
Des sentinelles microscopiques aux capacités insoupçonnées
Cette découverte révolutionnaire émerge du domaine naissant de l’immunométabolisme, une discipline qui explore les liens fascinants entre notre métabolisme cellulaire et nos défenses immunitaires. Les chercheurs ont mis au jour un mécanisme d’une complexité stupéfiante : les mitochondries possèdent des capteurs moléculaires capables de détecter des signaux chimiques spécifiques émis par les bactéries envahissantes.
Le signal en question ? Le lactate, cette molécule que nous associons habituellement à la fatigue musculaire après un effort intense. Dans le contexte des infections bactériennes, ce composé revêt une importance capitale. De nombreuses espèces bactériennes libèrent du lactate comme sous-produit de leur métabolisme énergétique, créant involontairement leur propre signature chimique.
Cette capacité de détection dépasse tout ce que les scientifiques imaginaient possible au niveau cellulaire. Les mitochondries parviennent à percevoir la présence de bactéries même lorsque celles-ci sont enfermées dans des compartiments cellulaires séparés appelés phagosomes – un exploit de coordination intracellulaire qui défie notre compréhension traditionnelle de la biologie.
L’art de la guerre microscopique
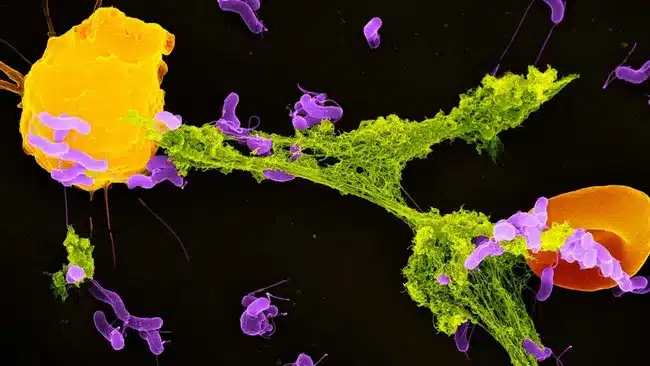
Une fois le lactate bactérien détecté, les mitochondries déclenchent une réponse immunitaire d’une redoutable efficacité. Elles communiquent avec les neutrophiles, ces globules blancs qui constituent nos premiers défenseurs contre les infections, pour initier la production de pièges extracellulaires appelés NET.
Ces NET représentent l’une des armes les plus sophistiquées de notre arsenal immunitaire. Composés d’ADN et de protéines antimicrobiennes, ils forment des structures filamenteuses comparables à des toiles d’araignées microscopiques. Leur fonction ? Capturer et neutraliser les microbes pathogènes, empêchant leur dissémination dans l’organisme.
Le processus révèle une stratégie défensive d’une intelligence remarquable. Lorsque les bactéries sont initialement capturées par les neutrophiles, elles continuent de produire du lactate à l’intérieur des phagosomes. Ce signal métabolique informe les mitochondries que les mécanismes antibactériens conventionnels s’avèrent insuffisants pour éliminer les intrus. En réponse, elles orchestrent la libération des NET, créant un piège externe plus efficace pour neutraliser définitivement les pathogènes.
Quand le système s’enraye : le paradoxe du lupus
Cette découverte éclaire d’un jour nouveau certaines pathologies auto-immunes mystérieuses, notamment le lupus érythémateux disséminé. Les patients atteints de cette maladie présentent un paradoxe médical troublant : malgré un système immunitaire en hyperactivité constante, ils souffrent paradoxalement d’infections récurrentes et peinent à éliminer les bactéries.
L’explication réside dans un dysfonctionnement mitochondrial subtil mais crucial. Chez ces patients, les mitochondries des neutrophiles perdent leur capacité à détecter correctement le lactate bactérien. Cette défaillance entraîne une production considérablement réduite de NET, affaiblissant dramatiquement les défenses antibactériennes.
Cette observation révèle l’équilibre délicat qui gouverne nos défenses immunitaires. Lorsque les mitochondries fonctionnent normalement, elles permettent aux neutrophiles de lancer des attaques ciblées et efficaces. Mais quand ce système de détection s’altère, l’ensemble de la stratégie défensive s’effondre, laissant l’organisme vulnérable aux infections bactériennes.
Des applications thérapeutiques révolutionnaires
Les implications cliniques de cette découverte s’étendent bien au-delà de la compréhension fondamentale des mécanismes immunitaires. Elle ouvre des perspectives thérapeutiques inédites pour traiter diverses pathologies infectieuses et auto-immunes.
Pour les patients immunodéprimés ou ceux souffrant de déficiences mitochondriales, des médicaments capables de restaurer ou d’amplifier la détection du lactate pourraient considérablement renforcer leurs défenses naturelles. Ces traitements stimuleraient la production de NET, compensant les défaillances du système de surveillance mitochondrial.
À l’inverse, dans certaines pathologies où les NET contribuent aux lésions tissulaires – comme les formes sévères de COVID-19 ou diverses maladies auto-immunes – il pourrait s’avérer bénéfique de moduler cette réponse. Des thérapies ciblant spécifiquement la détection mitochondriale du lactate permettraient de réduire les dommages collatéraux tout en préservant les mécanismes de défense essentiels.
Vers une médecine de précision cellulaire
Cette recherche s’inscrit dans une révolution scientifique plus large qui redéfinit notre conception du métabolisme cellulaire. Loin d’être un simple processus de production énergétique, le métabolisme émerge comme un système de communication complexe orchestrant nos réponses immunitaires.
Les mitochondries incarnent parfaitement cette nouvelle vision : elles ne sont plus seulement les centrales énergétiques de nos cellules, mais de véritables tours de contrôle immunitaire, surveillant continuellement l’environnement métabolique pour détecter les menaces potentielles. Cette découverte nous rapproche d’une médecine de précision capable de moduler finement nos défenses cellulaires, ouvrant la voie à des traitements plus ciblés et moins invasifs.


